- Q
-
您的統計軟體是否通過 FDA 驗證可用於醫療器材或藥品?
- A
-
我們經常被問到 Minitab 是否已通過美國食品藥物管理局 (FDA) 的驗證,應用於醫藥及醫療設備行業。
Minitab 內部廣泛的在作測試來驗證我們的軟體,但 Minitab 的統計軟體不是 — 也不能為 — FDA 確效 (FDA-validated)。
沒有任何軟體可以。
常見的誤解為:軟體供應商可以通過認證過程並取得 FDA 軟體確效 (FDA software validation)。實際上卻並非如此。
軟體供應商聲稱他們的產品是 FDA 確效時應進行審查。軟體購買者能自主來驗證軟體用於生產或作為品質系統的一部分時軟體的「預期用途 (intended use)」。如 FDA 的 Code of Federal Regulations Title 21 Part 820.70(i) 中所述︰
“When computers or automated data processing systems are used as part of production or the quality system, the manufacturer shall validate computer software for its intended use according to an established protocol. All software changes shall be validated before approval and issuance. These validation activities and results shall be documented.”
「當使用電腦或自動化資料處理系統作為生產或品質系統的一部分時,製造商應根據既定的協定驗證其電腦軟體的預期用途。所有軟體更動應在批准和發佈之前被驗證。這些驗證活動和結果應記錄成檔。」
FDA藉由軟體確效原則 (Principles of Software Validation) 的 Section 6 of “Validation of Automated Process Equipment and Quality System Software” in the Principles of Software Validation; Final Guidance for Industry and FDA Staff, January 11, 2002,為醫療設備公司提供額外的支援資訊。
“The device manufacturer is responsible for ensuring that the product development methodologies used by the off-the-shelf (OTS) software developer are appropriate and sufficient for the device manufacturer's intended use of that OTS software. For OTS software and equipment, the device manufacturer may or may not have access to the vendor's software validation documentation. If the vendor can provide information about their system requirements, software requirements, validation process, and the results of their validation, the medical device manufacturer can use that information as a beginning point for their required validation documentation.”
「設備製造商負責確保現成的 (off-the-shelf, OTS) 軟體開發人員所使用的產品開發方法,對於設備製造商關於該 OTS 軟體的預期用途是適當和足夠的。對於 OTS 軟體和設備,設備製造商可以要求或不要求供應商的軟體驗證文檔。如果供應商可以提供相關的系統需求、軟體要求、驗證過程,和其驗證結果的資訊,則醫療設備製造商可以使用該資訊作為所需驗證檔的起始。」
預期用途 (Intended Use)
「預期用途」的指導範例如下︰
XYZ 公司使用 Minitab 估計在製造過程中的缺陷機率。如果一種雜質的量超過了 450 毫克/毫升,該產品是不合格。讓我們假設他們使用 Minitab 的 Capability Analysis > Normal 執行能力分析。
如第一個圖所示,您可以看到 Ppk (1.26) 和缺陷率 (82 個缺陷/每百萬) 在大多數標準是相當不錯的。然而,這個製造商基於這些數值會誤以為這一個好的製程。
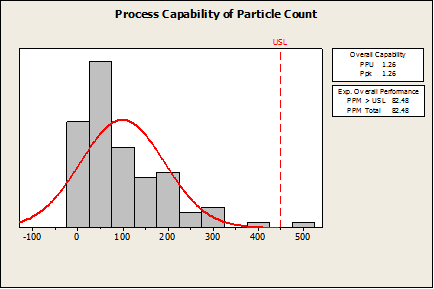
Minitab計算沒有任何不正確,但由於此資料非常態,這是一個錯誤的程序應用。如果這是 Minitab 中唯一可用的能力分析,那麼該軟體不會被驗證用於非常態能力分析 (non-normal capability analysis)。
幸運的是,Minitab 有非常態能力分析。如果選擇 Capability Analysis > Nonnormal 並選用適當的分佈 (在這種情況下為 Weibull),則發現 Ppk (0.69) 和缺陷率 (8993 個缺陷/每百萬) 較差,如下圖所示︰
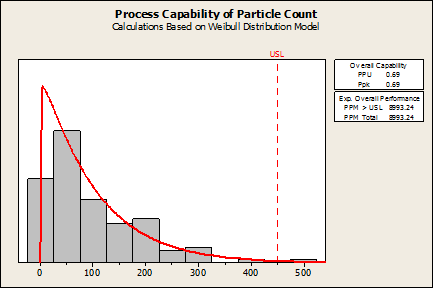
什麼需要被驗證?
用於監控製程和確定品質水準的套裝軟體,如 Minitab,應進行驗證。若要驗證 Minitab,您將需要記錄「預期用途 (intended use)」。
預期用途的驗證包含將軟體需求對應到測試案例。每個需求必須追溯到一個測試案例。如果發現需求沒有一個相應的測試案例,審核員可能會發現系統「未被驗證」。
您可以使用 Traceability Matrix 來追蹤您的需求和測試案例。
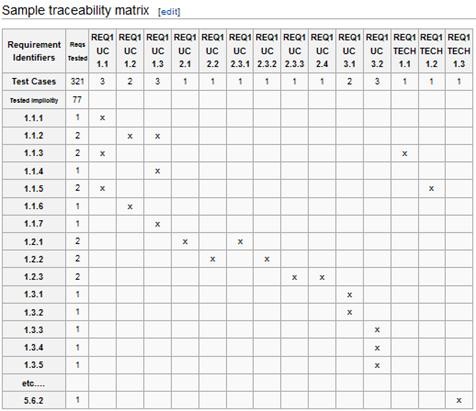
一個測試案例應包含︰
• 測試案例描述。例如,驗證非常態資料的能力分析。
• 執行的步驟。例如,到 Stat > Quality Tools > Capability Analysis > Nonnormal,然後輸入要進行評估的欄位並選擇適當的分佈。
• 測試結果 (螢幕截圖)。
• 測試通過/未通過檢測。
• 測試人員簽名和日期。
軟體確效警告信
許多製造業廠商接獲違反本條例規定的警告信。以下是來自警告信的一部分,指出現成服務支援軟體產品和文件管理工具驗證失敗。
5/29/2009
Failure to validate computer software for its intended use according to an established protocol when computers or automated data processing systems are used as part of production or the quality system as required by 21 CFR § 820.70(i). This was a repeat violation from a previous FDA-483 that was issued to your firm. For example:
A) Your firm uses off-the-shelf software (***** Help Desk) to manage customer support service calls and to maintain customer site configuration information; however, your firm failed to adequately validate this software in order to ensure that it will perform as intended in its chosen application. Specifically, your firm's validation did not ensure that the details screen was functioning properly as intended. The details screen is used to capture complaint details and complaint follow-up information which would include corrective and preventative actions performed by your firm when service calls are determined to be CAPA issues.
B) Off-the-shelf software (***************) is being used by your firm to manage your quality system documents for document control and approval. However, your firm has failed to adequately validate this software to ensure that it meets your needs and intended uses. Specifically, at the time of this inspection there were two different versions of your CAPA & Customer Complaint procedure, SOP-200-104; however, no revision history was provided on the *************** document history. Your firm has failed to validate the *************** software to meet your needs for maintaining document control and versioning.當使用電腦或自動化資料處理系統作為生產或品質系統的一部分,根據既定協定 21 CFR § 820.70(i) 要求,無法驗證其電腦軟體的預期用途。這是重複違反從前頒發給貴公司的 FDA 483。例如︰
A) 貴公司使用現成的軟體 (***** Help Desk) 管理客戶支援服務電話並維護客戶網站配置資訊;然而,貴公司未能充分驗證該軟體,以確保其在執行所選應用程式中的預期效果。具體而言,貴公司的驗證並不能確保詳細資訊螢幕如預期正常運行。詳細資訊螢幕用於取得投訴細節和投訴後續的訊息,其中包括貴公司在服務電話被確定為 CAPA 問題時所執行的糾正和預防措施。
B) 現成的軟體 (***************) 是被貴公司用於管理您品質系統文檔的文件管控和批准。然而,貴公司未能充分驗證此軟體,以確保它符合您的需求和預期用途。具體來說,在這次檢查的時間有兩個不同版本的 CAPA 和 客戶投訴程式 SOP-200-104;然而,沒有提供關於 *************** 文檔歷史的修訂歷程記錄。貴公司未能驗證 *************** 軟體,以符合維護文檔管控和版本控制的需求。
這裡列舉另兩個軟體驗證衝突的美國 FDA 警告信︰
3/25/2010
“Failure to validate computer software for its intended use according to an established protocol when computers or automated data processing systems are used as part of production or the quality system, as required by 21 CFR 820.70(i).“ … “when requested no validation documentation to support the commercial off-the-shelf program (b)(4) used to capture complaints, returned merchandise and service requests was provided.”「當根據 21 CFR 820.70(i) 的要求,使用電腦或自動化資料處理系統作為生產或品質系統的一部分時,根據既定的協議未能驗證其電腦軟體的預期用途。」…「當請求時沒有提供驗證文檔,以支持商業現成程式 (b)(4) 用於獲取投訴、退回商品和服務需求。」
2/25/2010
“Failure to validate computer software for its intended use according to an established protocol when computers or automated data processing systems are used as part of production or the quality system, as required by 21 C.F.R. §820.70(i) (Production and Process Controls – Automated Processes).” … “the CAPA analysis of nonconformances, which is used at management meetings, is inadequate in that the report is computer-generated on a non-validated software system.”「當根據 21 C.F.R. §820.70(i) (Production and Process Controls – Automated Processes) 的要求,使用電腦或自動化資料處理系統作為生產或品質系統的一部分時,根據既定的協議未能驗證其電腦軟體的預期用途。」...「管理會議上使用不合格的 CAPA 分析是不足的,這報告是在軟體系統未經驗證的電腦上生成。」
Minitab 的驗證資源
驗證軟體的預期用途是軟體購買者的責任。如果您正在使用 Minitab 統計軟體,我們提供資源來協助您驗證。您可以下載 Minitab 的軟體驗證工具包 (Minitab Software Validation Kit) 如下︰
http://www.minitab.com/support/software-validation/
此軟體驗證工具包旨在幫助您了解我們如何驗證 Minitab 統計軟體的市場準備情況,並確認 Minitab 對於品質的持續承諾。
如果您對於我們的軟體驗證程序有任何問題,請聯絡我們。